Elterliche Konflikttheorie im Umbruch
(23.5.17) In Pflanzen arbeiten während der Embryogenese die Gene von Vater und Mutter wie beim Tauziehen gegeneinander. Richtig? Nicht ganz – Freiburger Entwicklungsbiologen fanden heraus, dass direkt nach der Befruchtung beide Elternteile kooperieren.
Der Vater ein Egoist und die Mutter eine Gerechte? Wenn es um die Ressourcenverteilung bei Embryonen geht, war dies lange Zeit die gültige Meinung. Die „elterliche Konflikttheorie“, beschrieben vor fast dreißig Jahren von David Haig, Mark Westoby und Tom Moore, gilt sowohl für Pflanzen, als auch für Säugetiere und beschreibt ein Tauziehen zwischen elterlichen Genen (Am Nat 134: 147-55, Trends Genet 7: 45-9). Denn sobald der Embryo ausgiebig versorgt werden muss, sind sich die Eltern alles andere als einig. Die väterlichen Gene versuchen etwa, ihrem eigenen Spross das Bestmögliche zu sichern. Sie drängen die Mutter dazu, so viele Nährstoffe wie nur möglich an ihren Nachwuchs herauszurücken. Die Mutter ist davon wenig begeistert und hält dagegen: Sie verteilt ihre Ressourcen lieber an alle Nachkommen (also auch an die Zukünftigen) gleichmäßig.
Freiburger Entwicklungsbiologen haben nun in Kooperation mit ihrer Partneruniversität Nagoya in Japan und Kollegen aus Belgien entdeckt, dass sich die Eltern gar nicht immer so uneinig sind. „Zu Beginn der Embryogenese konnten wir zeigen, dass Mutter und Vater zusammenarbeiten“, erzählt Thomas Laux, leitender Professor der Studie (Genes Dev 31: 617-62). Als Versuchsobjekt knöpften sich die Forscher den Modellorganismus Arabidopsis thaliana, die Acker-Schmalwand, vor.

Thomas Laux (hinten) mit Co-Autor Ernst Aichinger und Co-Autorin Wen Gong. (Foto: Juliet Merz)
Fusionieren während der sexuellen Vermehrung die Eizelle und der Pollen der Pflanze miteinander, so ist das quasi das Startsignal für ein Genexpressionsprogramm. Ganz anders als bei den Tieren, wie Laux erklärt: „In der tierischen Zygote ist die Transkription erst einmal inaktiv.“ Die nötigen Proteine und RNAs bringt dort die Eizelle bereits mit. Die embryonale Transkription (zygotic genome activation, ZAG) beginnt erst nachdem der Embryo einige Zellteilungen durchlaufen hat.
In Pflanzen hingegen beginnt die Genexpression direkt nach der Befruchtung. Drei mütterliche Transkriptionsfaktoren spielen dabei eine ausschlaggebende Rolle. Während zwei der Faktoren bereits einsatzbereit sind, wartet der dritte, WRKY2, noch auf seine Aktivierung. Diese wird erst mit dem Eintritt des väterlichen Parts möglich. „Der Pollen des Vaters enthält mRNA, die bei der Fusion mit der Eizelle in die gebildete Zygote überführt wird“, konkretisiert Laux. Warum dieser Vorgang in Pflanzen abläuft, ist eine der spannenden, zukünftigen Fragen. Eine Hypothese ist, dass die Pflanze durch diesen Mechanismus verhindert, dass das embryonale Expressionsprogramm zufällig in Körperzellen aktiviert wird und sich auch ohne Befruchtung unkontrolliert Embryonen entwickeln.
Die mRNA des Vaters kodiert dann in der Eizelle für ein Protein namens SSP, welches in der Membran verankert ist und eine MAP-Kinase-Kaskade auslöst. Diese phosphoryliert daraufhin den inaktiven Transkriptionsfaktor WRKY2, der dadurch aktiviert wird. Zusammen mit den bereits startklaren, mütterlichen Transkriptionsfaktoren HDG11 und HDG12 bindet WRKY2 an das Intron des Masterregulators WOX8 und aktiviert dessen Transkription.
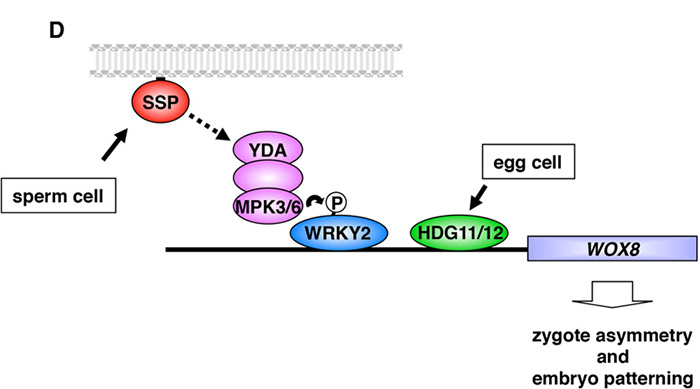
Zusammenspiel der unterschiedlichen Faktoren während der pflanzlichen Embryogenese. (Quelle: Ueda et al. (Genes Dev 31: 617-62))
WOX8 reguliert in Pflanzen viele Funktionen, beispielsweise die Asymmetrie des Embryos und damit die Ausbildung der Spross-Wurzel-Achse. Diese zeigt sich schon sehr früh in der Verteilung der Zellorganellen: Noch im Einzell-Stadion wandert der Zellkern der Zygote in den apikalen Teil, während die Vakuolen in der basalen Hälfte verstaut werden. Dadurch entstehen nach der Zellteilung der Zygote eine kleine apikale Tochterzelle, aus welcher der Embryo hervorgeht, und eine größere basale Zelle mit den meisten Vakuole, die zum Nahrungssuspensor wird und später zur Wurzelbildung beiträgt.
In Zukunft möchten Laux und Co. aber noch mehr entschlüsseln. Zum Beispiel, wie die unterschiedlichen Transkriptionsprogramme von Arabidopsis in Phänotypen übersetzt werden. Oder, ob die Embryonenmaschinerie deswegen so streng reguliert wird, damit sie ausschließlich in der Zygote ablaufen kann. „Wenn wir die Anschaltmechanismen der Embryogenese verstehen, sind wir in Zukunft möglicherweise in der Lage, somatische Embryonen, also asexuell entstandene Embryonen aus somatischen Zelle, auch in solchen Pflanzenarten zu gewinnen, in denen das bislang nicht gut funktioniert. Das ist beispielsweise der Fall bei vielen Nutzpflanzen“, so Laux.
Im Hinblick auf den Klimawandel und den wachsenden Bedarf an pflanzlichen Produkten (als Nahrung oder auch Energiequelle) könnte das von großer Bedeutung sein. Die altbewährte Methode wäre die Zucht von Pflanzen, die das jeweilige Klima besser tolerieren können. Doch diese Lösung ist sehr zeitaufwändig – Zeit, die der Mensch nicht hat. Anstatt mühselig Arten zu kreuzen und, wie zum Beispiel bei Bäumen, jahrzehntelang zu warten, bis aus den einzelnen Setzlingen ein ganzer Bestand gewachsen ist, könnten die Ergebnisse von Laux et al. in Zukunft Arbeit und Zeit sparen. Denn mit dem Verständnis der Embryogenese könnten womöglich eines Tages somatische Embryonen, also Pflanzenklone, aus zum Beispiel Wurzelzellen einfach und schnell gezüchtet werden. „Die Pflanzen müssten sich den Anforderungen der Menschen so rasant anpassen, dass sie auf natürliche Weise dazu keine Chance haben“, meint Laux. Der Menschheit bleibe durch den Klimawandel kaum mehr Zeit entsprechend zu reagieren, so Laux. „Wir brauchen eine zweite grüne Revolution.“
Juliet Merz










