Neue Impulse für die Krebstherapie durch Genomforschung?
Die Sequenzierung des menschlichen Genoms und die Weiterentwicklung von Hochdurchsatztechnologien haben den Boden für die Krebsgenomforschung bereitet. Wie gut sind ihre Ergebnisse?
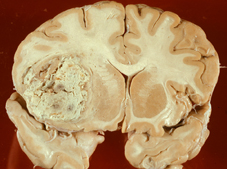
(23. September 2008) Anfang September erschienen drei mit Hochdurchsatztechnologien erstellte Genomstudien des Glioblastoms und des Pankreaskarzinoms in
Nature advance online publications und in
Scienceexpress (PMID: 18772890, 18772396 und 18772397). Beide Tumorarten sind schwer zu therapieren.
Eine der Glioblastomstudien stammt vom amerikanischen Cancer Genome Atlas Netzwerk, die andere und die Pankreaskarzinomstudie von Vogelstein et al. von der Johns Hopkins University in Baltimore.
Das Cancer Genome Atlas Netzwerk wurde 2006 ins Leben gerufen und soll die krebsverursachenden genetischen und epigenetischen Veränderungen in Tumoren katalogisieren. 13 US-Institutionen sind beteiligt. In der Glioblastomstudie analysierte das Netzwerk die Kopienzahl von Genen, die Expressionsprofile von mRNAs und microRNAs und die Methylierung an CpG-Dinukleotiden. Genetische Veränderungen der RTK/ RAS/ PI(3)K-, p53- und RB1-Signaltransduktionswege wurden festgestellt. Diese beeinflussen die Antwort der Gliazelle auf Wachstumsfaktorsignale, die Ausschaltung präkanzeröser Zellen durch Apoptose und Seneszenz und die Regulierung des Zellzyklus. Von 91 untersuchten Glioblastomen trugen 74 Prozent genetische Veränderungen in allen drei Signaltransduktionswegen. Eine Therapie, die gegen Ziele in allen drei Wegen gerichtet sei, könne das Glioblastom erfolgreich bekämpfen, vermuten die Forscher.
Die im Cancer Genome Atlas erfassten Daten sind teilweise öffentlich, teilweise nur mit Genehmigung zugänglich.
Das Team der Johns Hopkins University analysierte etwa 20 000 proteinkodierende Sequenzen in 22 Glioblastomen nach Kopienzahl und Expressionprofil. Auch hier zeigte die Mehrzahl der Tumore Änderungen in den p53-, RB1- und PI(3)K/ PTEN-Signaltransduktionswegen. Doch gab es auch andere genetische Veränderungen. 143 Gene waren zehnfach stärker in Glioblastomen exprimiert als in gesundem Kontrollgewebe. Ein vermutlich aktivierender Aminosäureaustausch in der Isozitrat-Dehydrogenase 1 (IDH1) fand sich in 12 Prozent der daraufhin untersuchten Glioblastome. IDH1 schützt die Zelle vor oxidativen Schäden. Das mutierte IDH1 Gen findet sich bei jüngeren Patienten und könnte als Marker für einen Glioblastomsubtyp dienen.
Bei der Pankreaskarzinomstudie fanden sich in 67 bis 100 Prozent der Tumore genetische Veränderungen in 12 zentralen Signaltransduktionswegen.
Die Funktionen vieler genetischer Elemente, die in Krebszellen verändert sind, sind unbekannt. Manche sind wesentlich für die Erkrankung, andere sind als Folge genomischer Instabilität der Krebszellen entstanden und haben keine Bedeutung für den Krankheitsverlauf. Ist eine genetische Veränderung bei bestimmten Krebsarten häufig, deutet dies auf eine Rolle bei der Krebsentstehung hin. Auch die Deregulierung einer Proteinaktivität in verschiedenen Tumorarten und über Speziesgrenzen hinweg lässt eine Schlüsselrolle bei der Krebsentstehung vermuten. Die krebsfördernde Funktion von Veränderungen auf Proteinebene kann in Krebszelllinien und
in vivo Studien studiert werden. In Verbindung mit klinischen Daten lassen sich Krebssubtypen dann biologische Leitmerkmale zuordnen. Die dienen als Indikatoren für Krankheitsverlauf und Therapien.
Leitmerkmale ermöglichen es auch Medikamente auf bestimmte genetische Patientengruppen zuzuschneidern. Bekannte Beispiele sind der monoklonale Antikörper Herceptin (Trastuzumab) und der Tyrosinkinase-Inhibitor Glivec (Imatinib). Herceptin dient zur Behandlung von Brustkrebspatienten, die das Leitmerkmal "Überexpression von HER2" aufweisen. Glivec wird eingesetzt zur Behandlung von Patienten mit chronisch myeloischer Leukämie und dem Leitmerkmal "Expression der Tyrosinkinase bcr-abl" und bei gastrointestinalen Stromatumoren wenn die Patienten das Leitmerkmal: "aktivierende Mutationen in der Rezeptor-Tyrosinkinase c-kit" aufweisen, sowie bei myelodysplastischen und myeloproliferativen Erkrankungen (Leitmerkmal: Rearrangements des Gens für den PDGF-Rezeptor).
Die Vorselektion von Patienten anhand von Leitmerkmalen kann darüber entscheiden, ob ein Medikament zugelassen wird, denn manchmal kann die Wirksamkeit einer Behandlung erst nach Vorselektion statistisch belegt werden, so bei der Entwicklung des Lungenkrebsmedikaments Iressa (Gefitinib) und des Brustkrebsmedikaments Herceptin (Trastuzumab). Zudem verringert sich die Zahl der Patienten für eine klinische Studie, wenn diese mit Leitmerkmalen vorher ausgewählt werden können. Dadurch können Studien schneller durchgeführt werden.
Genomische Analysen von therapieresistenten Krebszellen ermöglichen auch die Entwicklung von Medikamenten der zweiten Generation. Sie können Tumore bekämpfen, bei denen Resistenzen gegen Medikamente der ersten Generation aufgetreten sind. In klinischen Studien werden derzeit Medikamente an Tumoren getestet, die gegen Iressa resistent geworden sind. Darüber hinaus geben genomische Studien Hinweise, ob verschiedene Krebskrankheiten ähnliche molekulare Veränderungen zeigen und daher mit ähnlichen Medikamente behandelt werden können.
Bettina Dupont
Quellen: nature, Science, ncri conference 2007
Letzte Änderungen: 23.09.2008





 (23. September 2008) Anfang September erschienen drei mit Hochdurchsatztechnologien erstellte Genomstudien des Glioblastoms und des Pankreaskarzinoms in Nature advance online publications und in Scienceexpress (PMID: 18772890, 18772396 und 18772397). Beide Tumorarten sind schwer zu therapieren.
(23. September 2008) Anfang September erschienen drei mit Hochdurchsatztechnologien erstellte Genomstudien des Glioblastoms und des Pankreaskarzinoms in Nature advance online publications und in Scienceexpress (PMID: 18772890, 18772396 und 18772397). Beide Tumorarten sind schwer zu therapieren.