Proteinsektoren
von Daniela Kaulfus (Laborjournal-Ausgabe 1-2, 2010)
Endlich einmal Ordnung ins Chaos bringen – das könnte Rama Ranganathans Motivation gewesen sein, als er und seine Kollegen von der University of Texas in Dallas eine neue Hierarchie für Proteinstrukturen vorschlugen und den Begriff „protein sectors“ schufen.
Ordnung ins Chaos
Proteine sind ja ziemlich undurchsichtige Konstrukte aus vielen Aminosäuren, die sich aneinander ketten, falten, spiralisieren und sich verknäueln. Durchweg laborunfreundliche Strukturen, die den Blutdruck in die Höhe schießen oder das Forscherherz schneller schlagen lassen, je nach den persönlichen Vorlieben.
Die Pharmakologen um Ranganathan analysierten die konservierten Regionen der S1A-Serinproteasen, die rein aufs Rechnerische reduzierten „Laborratten“ der Gruppe. Diese Peptid-spaltenden Enzyme haben ein großes Spektrum an Substratspezifitäten und Umgebungen und kommen in fast allen Organismen vor. Typische Vertreter sind die Verdauungsenzyme Trypsin und Chymotrypsin.
Ranganathan wollte ein Ordnungssystem schaffen, mit dem sich die konservierten biologischen Eigenschaften eines Proteins erklären lassen, etwa die chemische Aktivität und Strukturstabilität. Die Forscher fanden heraus, dass die Aminosäuren der S1A-Proteine in drei funktionellen Einheiten organisiert sind, die sich von den klassischen strukturellen Hierarchien unterschieden, die auf der Sequenz oder der dreidimensionalen Form des Proteins basierten.
Gemeinsames Mutieren
Das spannende an Aminosäuren ist gleichzeitig die größte Herausforderung: Sie erfüllen ihre Aufgaben, indem sie miteinander kooperieren; und zwar nicht nur mit benachbarten, sondern auch mit in der Sequenz weit auseinanderliegenden Aminosäuren. Die Zusammenhänge dieser entfernten Aminosäuren rollt Ranganathan anhand einer Korrelationsmatrix auf, die vor 50 Jahren für die Finanzwelt entwickelt wurde. Das ursprüngliche Ziel dieser Matrix war es, im Börsengeschäft Zusammenhänge zwischen einzelnen Geschäftsfeldern zu erkennen, und zwar bereinigt von statistischem Rauschen wie etwa Korrelationen, die durch begrenzte Stichproben zustande kommen.
Umgelegt auf die Zusammenhänge von Aminosäuren nimmt Ranganathan die Idee „korrelierender Mutationen“ auf: Aminosäuren, die einander in der 3D-Struktur nahe sind und interagieren, sollten sich auch gemeinsam entwickeln. Mutation des einen Partners zöge demnach eine ausgleichende Mutation des anderen Partners nach sich. Diesen voneinander abhängig agierenden und co-evolvierenden Proteinbereichen gab Ranganathan den Namen „Proteinsektoren“ (
Cell 2009, 138:774-86).
Korrelationen in Sektoren
Der studierte Mediziner, Biologe und Bioinformatiker Ranganathan hat die Finanzmatrix nun ausgefeilt und ihr den Namen „Statistical Coupling Analysis“, kurz SCA, gegeben. Damit konnte er Korrelationssignale zwischen Aminosäuren aufdecken, indem er Zusammenhänge ausschloss, die aufgrund der Art der Stichproben zustande kommen können, wie zu geringe Stichproben (undersampling) und ungleiche Abstände in phylogenetischen Stammbäumen (historical noise).
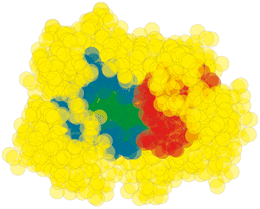
Das Ergebnis: 223 Sequenzpositionen von 1470 Mitgliedern der S1A-Familie zeigten 65 Korrelationen. Ranganathan teilte diese in drei Sektoren ein, die er der Anschaulichkeit wegen einfärbte (Bild oben):
- Der rote Protein-Sektor ist jener, der ein enges Netzwerk aus Aminosäuren um die S1-Tasche der Serinproteasen bildet und damit die Substratspezifität bestimmt.
- Im grünen Sektor befinden sich jene Aminosäuren, die das katalytische Zentrum bilden.
- Der blaue Sektor umschließt das katalytische Zentrum.
Die drei Proteinsektoren gehen nur wenige direkte Kontakte ein, obwohl sie räumlich nahe beieinander liegen. Diese Kontakte sind für die Funktion des ganzen Proteins allerdings essentiell. Das zeigten rechnerische Mutationen in einzelnen Sektoren: Tauscht man beispielsweise im roten Sektor alle Alanine gegen andere Aminosäuren aus, so ändert sich der grüne Sektor und damit die katalytische Aktivität des Proteins. Mutationen im blauen Sektor ändern die Temperaturstabilität des Proteins.
Farbige Zuständigkeiten
Positionsänderungen in einem Sektor beeinflussen also die anderen Proteinsektoren und können nicht unabhängig von ihnen betrachtet werden.
Der Versuch, mit Hilfe der Sektorensystems die verschiedenen S1A-Serinproteasen hinsichtlich ihrer Proteinsequenzen zu klassifizieren, scheiterte: 442 Vertreter dieser Proteinfamilie konnten weder nach ihrer enzymatischen Spezifität noch ihrem Vorkommen in unterschiedlichen Organismen eingeteilt werden.
Anhand der Sektoren allerdings funktioniert die Klassifizierung: Der rote Sektor eines Proteins bestimmt klar dessen enzymatische Spezifität und kann zum Beispiel als „Trypsin“ und „Chymotrypsin“ definiert werden. Der blaue Sektor bestimmt, ob das Protein in Wirbeltieren oder Wirbellosen vorkommt, und die Abschnitte des grünen Sektors definieren die Proteine als enzymatisch oder nicht enzymatisch aktiv.
Ranganathan et al. gehen davon aus, dass die Proteinsektoren im Laufe der Evolution unterschiedlich selektiert wurden und infolgedessen unterschiedliche biologische Eigenschaften erhalten haben. Er rechnet damit, dass auch bei anderen Proteinfamilien das „Ordnungsprinzip“ der Proteinsektoren herrscht.
Letzte Änderungen: 10.03.2010