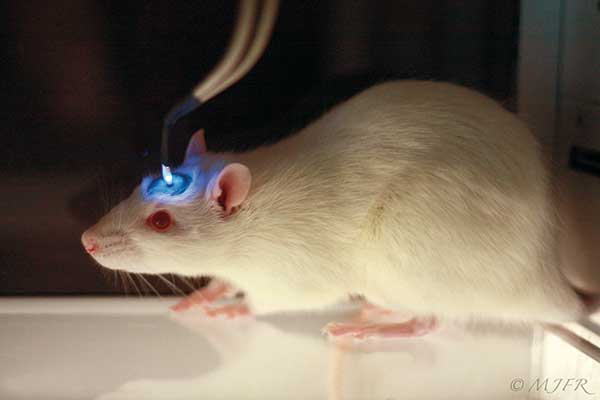
Lichtgesteuerte Zellen
Neue Optogenetik Werkzeuge
Andrea Pitzschke
Die Optogenetik kombiniert genetische und optische Methoden, um Zellen zu manipulieren. Sie beschränkt sich dabei längst nicht mehr nur auf Neuronen.
Optogenetiker fügen lichtsensitive Proteindomänen in Proteine ihrer Wahl ein, um diese mit Lichtreizen steuern zu können. Je nach Proteintyp und Strategie, führt die Beleuchtung zur Aktivierung, Inaktivierung, Lokalisation/Relokalisation oder Stabilisierung/Destabilisierung. Der wichtigste Baustein des optogenetischen Elements ist die Gensequenz eines Photosensors, die man in den Leserahmen des Zielgens einbaut.
Dimmbare Lichtschalter
Die transformierten Zellen exprimieren die licht-sensitiven Fusionsproteine und lassen sich mit einem Lichtschalter manipulieren. Mit „dimmbaren” Schaltern erzielt man hierbei nicht nur Schwarz-Weiß-Reaktionen, sondern kann behutsam an verschiedenen zellulären Schräubchen drehen. Aber kein Praktikant muss seine Laborzeit als Lampenbediener verbringen. Kommandos wie „Licht an/aus”, „Intensität rauf/runter”, „Wellenlänge x/y separat, nacheinander oder gleichzeitig” können vorher programmiert und bei Bedarf einfach abgespielt werden.
Optogenetische Methoden sind wesentlich präziser und behutsamer als alternative Verfahren. Je nach Setup kann der Experimentator zelluläre Mechanismen in Bruchteilen von Sekunden punktgenau auslösen. Und zwar genau so lange, wie er dies wünscht. Im Vergleich dazu schießen großflächig wirkende, chemische Induktionssysteme mit Kanonen auf Spatzen – zudem fehlt ihnen der „Ausschalter“.
Seit ihrer Entdeckung sprießen immer neue, maßgeschneiderte Photorezeptor-Varianten aus dem Boden, die genetisch kodiert und zur In-situ-Expression geeignet sind. Mit dem „richtigen“ Promoter und Lokalisationssignal versehen, landen sie im vorgesehenen Gewebe oder Kompartiment. Sie anzuregen ist, verglichen mit elektrischen oder chemischen Induktionssystemen, einfach, nicht-invasiv und reversibel. Das wiederholte An- und Abschalten „leiert“ die zelluläre Sensorik und Reaktionsfähigkeit nicht aus und es fallen auch keine chemischen Abbauprodukte mit unvorhersehbaren Nebenwirkungen an.
Reizverstärkung
Lichtsensitive Zellen tragen auf ihrer Oberfläche Antennenproteine, mit denen sie signalabhängig das Zell-Innenleben an die Außenwelt anpassen. Membranverankerte Photorezeptoren wie zum Beispiel Opsine haben eine extrazelluläre Sensor- und eine intrazelluläre Effektordomäne. Außen wahrgenommene Lichtreize bewirken strukturelle Veränderungen, die bis in die cytosolische Domäne hinein reichen. Da ein Effektormolekül dank seiner Enzymfunktion mehrere Zielmoleküle steuern kann, wird die Reizinformation verstärkt. Ein Photon kann so zum Beispiel tausende Phosphorylierungen auslösen.
Alle Photosensoren tragen organische Chromophoren, die das Licht einfangen. Je nach Chromophor unterscheiden sich Photosensoren in ihren Absorptionseigenschaften. Ein UV-B-Rezeptor aus Arabidopsis (UVR8) beispielsweise reagiert aufgrund seines Tryptophan-Chromophors auf die Bestrahlung mit kurzwelligem (300 nm) Licht. Bilin-tragende Bakterienphytochrome sprechen dagegen auf langwelliges Licht (800 nm) an.
Vor der Wahl eines Rezeptors sollte man abklären, welche Lichtquellen zur Verfügung stehen, wie tief das Licht in das jeweilige Gewebe vordringen soll und welche Wellenlängen man besser vermeidet. Letzteres ist insbesondere bei Mehrfarben-Systemen wichtig, bei denen verschiedene Proteine unabhängig voneinander auf das Licht reagieren sollen. Zudem muss das entsprechende Chromophor im anvisierten Gewebe schon in genügender Menge vorhanden sein. Erfreulicherweise bringen die meisten Zellen die nötigen Chromophore selbst mit. Zum Beispiel ist Tryptophan nicht nur eine Aminosäure, sondern funktioniert auch als Chromophor für UVR8.
Farben Tuning
Treffen Lichtstrahlen auf ein Gewebe, so werden sie unterschiedlich stark abgebremst, vor allem von Pigmenten und Lipiden. Infrarotstrahlen, deren Wellenlängen über 700 nm liegen, werden dagegen weit weniger abgelenkt. Eine schlechte Durchdringung bedeutet, dass der Reiz nicht bis zu allen Sensormolekülen vordringt. Also die Lichtzufuhr steigern? Cleverer, und gewebsschonender ist das sogenannte „Farben-Tuning“, bei dem man durch Austausch einzelner Aminosäuren die Absorptionseigenschaften und -sensitivität der Photorezeptoren manipuliert.
G-Protein gekoppelte Rezeptoren (GPCRs) und Rezeptortyrosin-Kinasen (RTKs), die normalerweise auf extrazelluläre Liganden reagieren, sind bei Optogenetikern besonders beliebt. Koppelt man lichtsensitive Domänen an diese Rezeptoren, so lässt sich der entsprechende Signalleitungsweg Ligand-unabhängig steuern.
Ein Beispiel hierfür ist der auf Säuger-Rhodopsinen sowie Liganden-gesteuerten GPCRs basierende Photosensor OptoXR. Mit seiner Hilfe lässt sich ein chemisch stimulierbarer, adrenergener oder Serotonin-abhängiger Signalweg mit Licht kontrollieren.
Lichtkontrollierte Kinase
Ganz ähnlich funktionieren sogenannte Light-Oxygen-Voltage-(LOV)-Sensordomänen, die in Phytochromen beziehungsweise Phototropinen diverser Bakterien, Pilze und Pflanzen vorkommen. Wie das vollständige Phytochrom-Molekül, dimerisieren auch LOV-Domänen, wenn sie beleuchtet werden. Hängt man eine LOV-Domäne an eine RTK (die sich normalerweise nach der Ligandenbindung an ihre Rezeptordomäne zu enzymatisch aktiven Dimeren zusammenfinden), so erhält man eine Kinase, die ihre gewohnten Signalwege im Zellinneren auslöst. Nur benötigt sie hierfür keinen Liganden, sondern Blaulicht.
Die Einsatzmöglichkeiten von LOV- und anderen Sensordomänen beschränken sich aber nicht nur auf Rezeptorkinasen oder andere membrangängige Proteine. Licht kann bis ins Zellinnere vordringen und steuert unter anderem auch die Oligomerisierung vieler Transkriptionsfaktoren sowie Transportproteine.
LOV-Domänen funktionieren also auch im Zellinneren. Beim sogenannten „Peptide Uncaging“ hängt man eine LOV-Domäne an ein Enzym das man regulieren will. Fällt Licht auf die LOV-Domäne, so löst sich die katalytische Domäne des Enzyms, wird aktiv oder endet in den gierigen Mäulern von Proteasen. Über LOV-vermitteltes Peptide Uncaging können Optogenetiker sogar ein Protein per Lichtschalter in den Zellkern dirigieren. Hierfür müssen sie lediglich das Kernlokalisationssignal (NLS), beispielsweise eines Transkriptionsfaktors, mit einer LOV-Domäne maskieren.
Zurechtgezimmerte Kalziumkanäle
Auch für Eingriffe in den Kalziumhaushalt einer Zelle haben Optogenetiker etwas in ihrer Trickkiste parat. Sogenannte Genetically-Encoded-Ca2+-Actuators (GECAs) sind Nicht-Opsin-Proteine, die aus natürlich vorkommenden Ca2+-aktivierbaren Kalziumkanälen (CRAC) zurechtgezimmert wurden. Auch hier verwenden Optogenetiker die LOV-Domäne: Eine LOV2-Fusion mit der Ca2+-Bindedomäne in Calmodulin hält Kalzium im Dunkeln wie ein Chelator fest. Unter Blaulicht entfaltet sich LOV2, die Bindedomäne verliert ihre Ca2+-Affinität und entlässt Kalzium in die Freiheit. Da viele zelluläre Mechanismen auf Änderungen in der Kalzium-Verteilung basieren, liefern CRACs reichlich Manipulationsspielraum.
Lichtsensoren taugen jedoch nicht nur als Steuereinheiten, sondern auch als Reporter. Der Trick besteht darin, Sensoren über ihre Chromophoren Licht empfangen zu lassen, das sie aber nicht in die Bildung von Dimeren oder ähnlichen Umstrukturierungen umsetzen können. Stattdessen fluoreszieren sie. Je nach Umgebungsbedingung können sie hierbei sogar ihre Farbe ändern. Sie verraten folglich die Position ihres Fusionspartners, beeinträchtigen seine Eigenschaften jedoch nicht. Und wie könnte es anders sein: Auch hierzu verwenden Optogenetiker die LOV-Domäne. Diese hat aber noch andere Vorzüge gegenüber GFP als nur die kleinere Größe: Während GFP auf Sauerstoff angewiesen und bei pH-Werten unter fünf instabil ist, funktioniert LOV auch in anaeroben Systemen und sauren Milieus.
Umgepolte Kationenpumpe
Manipulationen des elektrischen Potenzials einer Zelle ermöglichen lichtgesteuerte Ionenkanäle aus der Klasse der Rhodopsine, die Licht in elektrochemische Signale umwandeln.
Das Team des Optogenetik-Pioniers Peter Hegemann von der Humboldt-Universität Berlin verwandelte zum Beispiel ein „klassisches” Kationen-Kanalrhodopsin in einen Kanal, der Anionen transportiert (Science 344(6182): 409-12). Mit dem umgepolten und optimierten Kanalrhodopsin inhibierten Hegemanns Mitarbeiter Neuronen auf Kommando mit Lichtimpulsen. Kurze Zeit später fand eine amerikanische Gruppe einen natürlichen Chlorid-leitendenden Kanal (ChloCs GtACR1/2) in einer Alge, mit dem die Forscher ebenfalls Neuronen gezielt an- und ausschalteten (Science 349(6248): 647-50).
Im letzten Jahr war dann wieder Hegemanns Team an der Reihe. In der Alge Proteomonas sulcata fand die Gruppe einen weiteren Anionenkanal (PsACR1), dessen Absorptionsmaximum jedoch zu rötlichen Wellenlängen verschoben ist. Die Gruppe verwendete PsACR1 deshalb für die Steuerung Blaulicht-sensitiver Kationen-Kanäle mit zwei verschiedenen Farben (J Biol Chem 291(8): 4121-7).
Prallgefüllte Trickkiste
Optogenetiker haben inzwischen eine Vielzahl künstlicher Photorezeptoren und chimärer, lichtgesteuerter Proteine erzeugt, die auf unterschiedliche Wellenlängen reagieren und verschiedene Effekte in Zellen auslösen. Grundlagenforscher und Photobiologen können sich also aus einer prallgefüllten optogenetischen Werkzeugkiste bedienen, die kreative Wissenschaftler ständig mit neuen Tools ergänzen.
Ob optogenetische Therapieansätze, wie von manchen gemutmaßt, in Zukunft sogar Pillen oder Spritzen überflüssig machen und zum Beispiel Blinden zu neuem Augenlicht verhelfen, wird man sehen.
Letzte Änderungen: 06.03.2017