Tipp 99:
Aufgepeppte Kryokonservierungslösung
"Sehr geehrtes Laborjournal-Team,
das folgende Protokoll für die Kryokonservierung von Hirnschnitten habe ich vor einigen Jahren bei einem Aufenthalt im Labor von Prof. Daniel Peterson an der Finch Medical School in Chicago aufgeschnappt und nun gemeinsam mit dem von mir betreuten Diplomanden Alexander Hawlitschka erstmals angewandt.
Es erleichtert deutlich die Durchführung immunhistochemischer Färbungen, da sich frei flottierende Hirnschnitte bis zur Aufarbeitung mehrere Monate (angeblich Jahre) lagern lassen. Die Gehirne mehrerer Versuchstiere können zunächst einmal geschnitten und danach unterschiedliche immunhistochemische Färbungen von Serienschnitten angefertigt werden. Bislang haben wir nur Erfahrung mit Gehirngewebe gesammelt. Mit Kryostatschnitten anderer Organe könnte sicher auch so verfahren werden.
So funktioniert's:
126 ml Glycerol (87 %), 150 ml Ethylenglycol und 250 ml Phosphatpuffer (PBS, 0,1 M, pH 7,4) mischen. Vor dem Einfrieren in -50 °C kaltem Isopentan werden die formalinfixierten Hirne (3,7 % in PBS) über Nacht in 20prozentiger-Saccharoselösung (Zucker aus dem Supermarkt) kryoprotektiert und bis zum Aufarbeiten bei -80 °C gelagert.
Anschließend die am Kryostaten angefertigte Hirnschnitte (20-30 µm dick) mit einem feuchten Pinsel (PBS bereitstellen) aufnehmen und in die Einfrierlösung überführen und bei -20 °C lagern. Die Lösung ist dann noch flüssig!
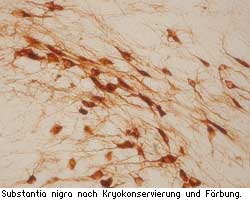
Wir sammeln die Hirnschnitte in 48er-Well Platten (0,5 ml Lösung pro Well und Schnitt). Dadurch können parallele Serienschnitte später gut zugeordnet werden. Für Maushirne könnten sicher auch 96er-Well Platten ausreichen (0,2 ml Lösung). Vor der immunhistochemischen Markierung sollen die Hirnschnitte 2 x 10 min in PBS gewaschen werden. Vergleiche mit Präparaten die direkt nach dem Schneiden in PBS aufgenommen und gefärbt wurden ließen keine Unterschiede erkennen (siehe Abbildung rechts). Es ist ratsam erst einmal Probeschnitte für die entsprechenden Färbungen anzufertigen, da diese Kryokonservierung auch negative Einflüsse auf bestimmte Epitope besitzen könnte."
Alexander Hawlitschka nutzt einen weiteren Trick beim Aufziehen frei flottierender Schnitte:
"Das fummelige Aufziehen frei flottierender Hirnschnitte auf Objektträgern im Wasserbad (Aqua dest.) nach der Immunohistochemie hat mich dazu angeregt einfach mal die Oberflächenspannung mittels Triton X100 zu reduzieren (ca. 50 µl auf 500 ml Aqua dest.). Es klappt ganz ordentlich, denn nun verrutschen die Schnitte nicht mehr beim Rausziehen des Objektträgers aus dem Wasserbad und es entstehen dadurch gleichzeitig weniger Falten in den Präparaten. Vergleiche mit Präparaten bei denen kein Triton verwendet wurde lassen keine Unterschiede beim Färbeergebnis erkennen, jedoch sind nun viel weniger Falten auf den Präparaten."
Stefan Haas und Alexander Hawlitschka,
Institut für Anatomie, Universität Rostock
Letzte Änderungen: 24.04.2006